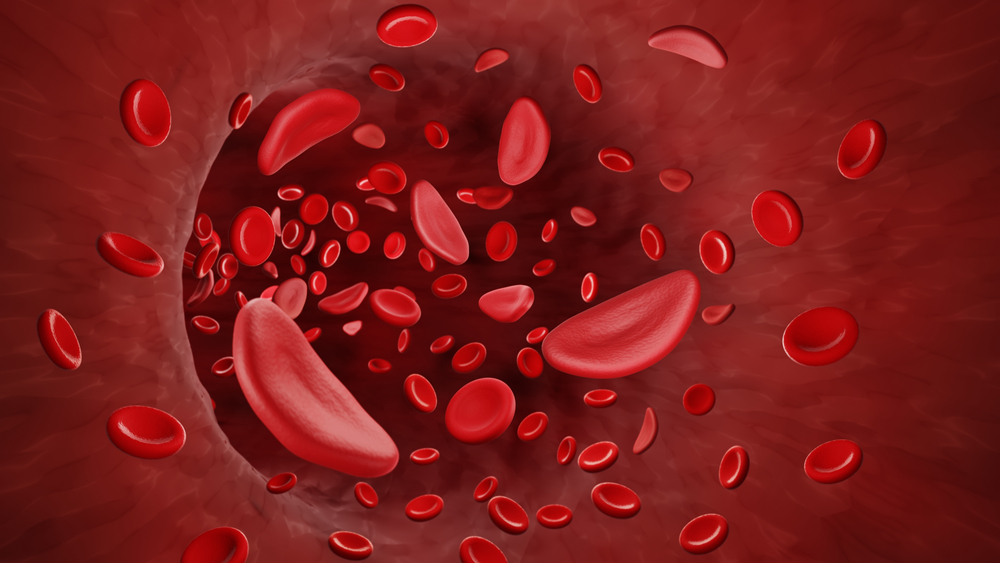
Niedokrwistość sierpowatokrwinkowa (ang. Sickle cell disease, SCD) to dziedziczna choroba krwi, która wpływa na kształt i funkcjonowanie czerwonych krwinek. W zdrowym organizmie erytrocyty mają elastyczny, dyskowaty kształt i swobodnie przepływają przez naczynia krwionośne, dostarczając tlen do tkanek. U osób z SCD krwinki przybierają kształt sierpa – są sztywne, kruche i mają tendencję do zlepiania się oraz blokowania przepływu krwi.
To prowadzi do poważnych objawów, takich jak silny ból, chroniczne zmęczenie, uszkodzenia narządów i zwiększona podatność na infekcje. Choroba najczęściej występuje u osób pochodzenia afrykańskiego, śródziemnomorskiego, bliskowschodniego i indyjskiego, ale może dotyczyć każdego, kto odziedziczył wadliwy gen od obojga rodziców.
Mimo że niedokrwistość sierpowatokrwinkowa jest chorobą przewlekłą i potencjalnie zagrażającą życiu, dzięki postępom w medycynie możliwe jest skuteczne łagodzenie objawów i poprawa jakości życia pacjentów. W artykule przyjrzymy się bliżej mechanizmom tej choroby, jej objawom, metodom diagnozy oraz aktualnym możliwościom leczenia.
Czym jest niedokrwistość sierpowatokrwinkowa?
Niedokrwistość sierpowatokrwinkowa (Sickle Cell Disease, SCD) to monogenowa, dziedziczona autosomalnie recesywnie hemoglobinopatia, charakteryzująca się obecnością nieprawidłowej hemoglobiny typu S (HbS) w erytrocytach. Mutacja punktowa w genie HBB, zlokalizowanym na krótkim ramieniu chromosomu 11, prowadzi do substytucji kwasu glutaminowego przez walinę w 6. pozycji łańcucha β-globiny.
W warunkach obniżonego ciśnienia parcjalnego tlenu, HbS ma skłonność do polimeryzacji, co skutkuje zmianą kształtu erytrocytów z dyskowatego na sierpowaty (półksiężycowaty). Te zmienione morfologicznie krwinki są mniej elastyczne, bardziej adhezyjne i wykazują zwiększoną podatność na hemolizę.
Konsekwencje patofizjologiczne obejmują:
- przewlekłą hemolityczną niedokrwistość,
- okluzyjne epizody naczyniowe (tzw. kryzysy bólowe) wynikające z zatorów mikrokrążenia,
- zwiększone ryzyko infekcji,
- oraz uszkodzenia wielonarządowe (w tym m.in. śledziony, nerek, płuc, mózgu).
Pełnoobjawowa postać choroby występuje u osób homozygotycznych (HbSS), natomiast osoby heterozygotyczne (HbAS) są zazwyczaj nosicielami mutacji i rzadko wykazują objawy kliniczne – mówi się wówczas o anemii sierpowatej w postaci łagodnej.
Sierpowate krwinki:
- szybciej się rozpadają (co prowadzi do niedokrwistości – zbyt małej liczby zdrowych krwinek),
- zlepiają się i blokują naczynia krwionośne (co prowadzi do bólu, zawałów tkanek i uszkodzeń narządów).
Choroba ma charakter dziedziczny – występuje, gdy dziecko odziedziczy wadliwy gen hemoglobiny od obojga rodziców (układ homozygotyczny). Jeśli tylko jeden z rodziców przekazuje mutację, mówimy o tzw. nosicielstwie (anemia sierpowata w formie łagodniejszej, zwykle bezobjawowej).
Niedokrwistość sierpowatokrwinkowa nie jest chorobą zakaźną i nie można się nią zarazić. To schorzenie genetyczne, które trwa przez całe życie i wymaga specjalistycznej opieki medycznej, aby zminimalizować ryzyko powikłań i poprawić jakość życia pacjenta.
Warto przeczytać: Co jeść przy niedoborze białych krwinek?
Niedokrwistość sierpowatokrwinkowa stanowi istotny problem w wielu regionach świata, szczególnie w Afryce Subsaharyjskiej, Indiach, na Bliskim Wschodzie i w rejonach basenu Morza Śródziemnego. W krajach rozwiniętych prowadzi się przesiewowe badania noworodków, co umożliwia wczesne rozpoznanie i wdrożenie odpowiedniego leczenia.
Objawy choroby sierpowatokrwinkowej
Objawy niedokrwistości sierpowatokrwinkowej (SCD) są wynikiem dwóch głównych procesów patofizjologicznych: przewlekłej hemolizy oraz okluzji naczyń krwionośnych przez zdeformowane erytrocyty. Ich nasilenie i częstotliwość mogą się różnić w zależności od fenotypu choroby, wieku pacjenta oraz obecności powikłań narządowych.
Przewlekłe zmęczenie i osłabienie
Jednym z najczęstszych i najbardziej uporczywych objawów niedokrwistości sierpowatokrwinkowej jest przewlekłe uczucie zmęczenia. Wynika ono przede wszystkim z niedokrwistości hemolitycznej, czyli zbyt szybkiego rozpadu czerwonych krwinek, które nie są w stanie skutecznie transportować tlenu do tkanek. W efekcie dochodzi do hipoksji komórkowej, objawiającej się brakiem energii, osłabieniem mięśniowym, trudnościami w koncentracji, a u dzieci także ograniczoną tolerancją wysiłku i spowolnionym rozwojem psychoruchowym.
Uczucie zmęczenia może być dodatkowo nasilane przez niedobory składników odżywczych (np. kwasu foliowego), przewlekły stan zapalny oraz częste infekcje, które obciążają organizm. W codziennym funkcjonowaniu pacjenci mogą odczuwać potrzebę częstszego odpoczynku, rezygnować z aktywności fizycznej, a nawet mieć trudności z utrzymaniem pracy czy nauki w pełnym wymiarze.
Przewlekłe bóle (epizody okluzji naczyniowej)
To jeden z najbardziej charakterystycznych objawów klinicznych SCD. Dochodzi do nich, gdy sierpowate krwinki blokują przepływ krwi w naczyniach włosowatych, powodując niedotlenienie tkanek. Ból:
- występuje najczęściej w kościach, stawach, klatce piersiowej i jamie brzusznej,
- może mieć charakter nawracający lub przewlekły,
- często wymaga hospitalizacji i leczenia opioidami.
Osobny artykuł poświeciliśmy tematowi bólów głowy przy anemii.
Zwiększona podatność na infekcje
Pacjenci z niedokrwistością sierpowatokrwinkową wykazują znacznie zwiększoną podatność na infekcje, szczególnie bakteryjne, co stanowi jedno z najpoważniejszych zagrożeń w przebiegu choroby, zwłaszcza u dzieci. Główną przyczyną jest uszkodzenie lub zanik funkcji śledziony (autosplenektomia), narządu pełniącego kluczową rolę w eliminowaniu patogenów, zwłaszcza bakterii otoczkowych, takich jak Streptococcus pneumoniae, Haemophilus influenzae i Neisseria meningitidis.
Warto przeczytać: 7 ziół i przypraw, które wzmacniają odporność
Brak prawidłowej filtracji krwi przez śledzionę prowadzi do zaburzeń odporności humoralnej, szczególnie upośledzonej produkcji przeciwciał typu IgM. Dodatkowo, przewlekła hemoliza i niedotlenienie mogą wpływać negatywnie na aktywność układu odpornościowego jako całości.
W praktyce klinicznej często obserwuje się nawracające infekcje dróg oddechowych, zapalenia płuc, zapalenia ucha środkowego, zakażenia układu moczowego, a także poważniejsze powikłania, takie jak posocznica, zapalenie opon mózgowo-rdzeniowych czy zapalenie kości i szpiku kostnego.
Zaburzenia wzrostu i rozwoju
U dzieci często obserwuje się:
- opóźnienie wzrostu i dojrzewania płciowego,
- zmniejszenie masy ciała,
- deformacje kostne (np. pogrubienie kości czaszki wskutek aktywności szpiku kostnego).
Żółtaczka i ciemne zabarwienie moczu
Rozpad krwinek prowadzi do hiperbilirubinemii, objawiającej się:
- żółtym zabarwieniem skóry i twardówek oczu,
- ciemnym moczem (bilirubinuria),
- zwiększonym ryzykiem kamicy żółciowej.
Powikłania narządowe (występujące z czasem)
- Zespół ostrej klatki piersiowej – nagły ból w klatce piersiowej, gorączka, duszność; stan zagrożenia życia.
- Udar mózgu – zwłaszcza u dzieci i młodych dorosłych.
- Nefropatia sierpowatokrwinkowa – zaburzenia czynności nerek, krwiomocz.
- Martwica głowy kości udowej i innych kości – na skutek niedokrwienia.
- Zaburzenia widzenia – wynikające z niedokrwienia siatkówki.
Priapizm
Długotrwały, bolesny wzwód prącia, niezwiązany z pobudzeniem seksualnym, występujący wskutek zastoju krwi i mikrozatorów. Może prowadzić do trwałych zaburzeń erekcji.
Problemy z płodnością i ciążą
U kobiet:
- zwiększone ryzyko powikłań ciążowych, poronień, stanu przedrzucawkowego.
U mężczyzn:
- ryzyko niepłodności (np. wtórne do powikłań po leczeniu hydroksymocznikiem lub przebytym priapizmie).
Objawy choroby sierpowatokrwinkowej mają charakter systemowy i wielonarządowy, a ich nasilanie się może prowadzić do istotnego pogorszenia jakości życia i skrócenia długości życia pacjenta. Wczesne rozpoznanie oraz kompleksowa opieka interdyscyplinarna są kluczowe w minimalizowaniu ryzyka ciężkich powikłań.
Jakie są przyczyny i mechanizm niedokrwistości sierpowatokrwinkowej?
Niedokrwistość sierpowatokrwinkowa jest chorobą genetyczną o dziedziczeniu autosomalnym recesywnym. Jej bezpośrednią przyczyną jest mutacja punktowa w genie HBB, zlokalizowanym na krótkim ramieniu chromosomu 11, kodującym łańcuch β-globiny hemoglobiny. W wyniku tej mutacji dochodzi do zamiany jednego aminokwasu – kwasu glutaminowego na walinę w 6. pozycji łańcucha β (mutacja Glu6Val), co prowadzi do powstania nieprawidłowej formy hemoglobiny: hemoglobiny S (HbS).
U osób homozygotycznych (HbSS), czyli posiadających dwie kopie zmutowanego genu, występuje pełnoobjawowa postać choroby. Osoby heterozygotyczne (HbAS) są zazwyczaj nosicielami i mają łagodniejszy lub bezobjawowy przebieg kliniczny (tzw. cecha sierpowatokrwinkowa).
Mechanizm choroby
- Polimeryzacja hemoglobiny S
W warunkach fizjologicznego obniżenia ciśnienia parcjalnego tlenu (np. w drobnych naczyniach włosowatych) hemoglobina S ma tendencję do agregacji i polimeryzacji, tworząc wewnątrz erytrocytu sztywne włókna. - Zmiana kształtu erytrocytu
Polimeryzacja HbS powoduje deformację czerwonej krwinki – z typowej, elastycznej formy dwuwklęsłego dysku na sztywny, sierpowaty kształt. Takie krwinki:- tracą elastyczność,
- są bardziej podatne na uszkodzenia,
- mają znacznie skrócony czas przeżycia (do 10–20 dni).
- Zlepianie i adhezja komórek
Sierpowate krwinki wykazują zwiększoną adhezję do śródbłonka naczyń krwionośnych oraz do siebie nawzajem, co sprzyja tworzeniu mikrozatorów w mikrokrążeniu. Efektem są:- niedokrwienie i uszkodzenie tkanek,
- silne epizody bólowe (tzw. kryzysy naczyniowo-okluzyjne),
- uszkodzenia narządowe (mózg, płuca, nerki, kości).
- Przewlekła hemoliza
Zniekształcone erytrocyty są rozpoznawane jako patologiczne i szybko usuwane przez układ siateczkowo-śródbłonkowy, głównie w wątrobie i śledzionie. Powoduje to:- niedokrwistość hemolityczną,
- wzrost poziomu bilirubiny (żółtaczka, kamica żółciowa),
- zwiększone zapotrzebowanie na erytropoezę (produkowanie nowych krwinek w szpiku).
Skutki mechanizmu choroby
Patomechanizm niedokrwistości sierpowatokrwinkowej prowadzi do zespołu powikłań obejmujących wiele układów:
- układ krążenia (np. niewydolność serca),
- układ nerwowy (np. udary),
- układ moczowy (np. białkomocz, przewlekła choroba nerek),
- układ oddechowy (zespół ostrej klatki piersiowej),
- układ kostno-stawowy (np. martwica jałowa kości).
W jaki sposób jest diagnozowana niedokrwistość sierpowatokrwinkowa?
Diagnostyka niedokrwistości sierpowatokrwinkowej (SCD) opiera się na analizie laboratoryjnej krwi w celu wykrycia obecności nieprawidłowej hemoglobiny S (HbS) oraz oceny jej wpływu na funkcjonowanie organizmu. W krajach rozwiniętych wprowadzono także obowiązkowe programy przesiewowe dla noworodków, co umożliwia bardzo wczesne rozpoznanie choroby i wdrożenie opieki medycznej jeszcze przed wystąpieniem pierwszych objawów.
Badania przesiewowe (screening noworodków)
W wielu krajach (np. USA, Wielka Brytania, Francja) wykonuje się rutynowe badania przesiewowe u noworodków w kierunku hemoglobinopatii.
- Materiałem jest zazwyczaj krew z pięty, pobierana w ciągu pierwszych dni życia.
- Wczesne wykrycie umożliwia natychmiastową profilaktykę zakażeń (np. poprzez podanie penicyliny i szczepienia).
Elektroforeza hemoglobiny (lub HPLC)
To podstawowe badanie diagnostyczne służące do identyfikacji i rozróżnienia typów hemoglobiny:
- W przypadku SCD stwierdza się obecność hemoglobiny S (HbS) oraz brak lub znaczne obniżenie poziomu hemoglobiny A (HbA).
- U osób heterozygotycznych (nosicieli – HbAS) obecne są zarówno HbA, jak i HbS.
Alternatywnie stosuje się wysokosprawną chromatografię cieczową (HPLC), która jest dokładniejsza i często używana w laboratoriach referencyjnych.
Testy potwierdzające – badania molekularne
W celu potwierdzenia diagnozy lub wykonania diagnostyki prenatalnej wykorzystuje się analizę DNA.
- Badania genetyczne pozwalają wykryć mutację punktową w genie β-globiny (HBB) odpowiedzialną za powstanie HbS.
- Stosuje się je także w diagnostyce nosicielstwa i w planowaniu rodziny.
4. Morfologia krwi (CBC – complete blood count)
Typowe wyniki obejmują:
- niedokrwistość normocytowa lub mikrocytarna,
- obniżony poziom hemoglobiny i hematokrytu,
- retikulocytoza – zwiększony poziom młodych erytrocytów jako reakcja kompensacyjna na hemolizę.
Rozmaz krwi obwodowej
Pod mikroskopem można zauważyć charakterystyczne zmiany:
- erytrocyty o sierpowatym kształcie,
- poikilocytozę (różnorodność kształtów krwinek),
- ciałka Howell-Jolly’ego (świadczące o dysfunkcji śledziony).
6. Test solny (sickle cell test) (rzadziej stosowany)
Starsza, szybka metoda diagnostyczna polegająca na indukowaniu warunków hipoksji in vitro – sierpowacenie erytrocytów świadczy o obecności HbS. Test ten nie pozwala na odróżnienie nosicielstwa od pełnoobjawowej choroby.
Diagnostyka prenatalna
W rodzinach obciążonych ryzykiem choroby można wykonać diagnostykę prenatalną:
- na podstawie próbki kosmówki (CVS) lub płynu owodniowego (amniopunkcja),
- w celu wykrycia mutacji genu HBB u płodu.
Dodatkowe badania pomocnicze (w ocenie powikłań)
- USG jamy brzusznej i echokardiografia – ocena narządów wewnętrznych.
- Badanie moczu – obecność białkomoczu, krwiomoczu.
- Rezonans magnetyczny (MRI) – w podejrzeniu udaru mózgu lub martwicy kości.
- TCD (transcranial Doppler) – u dzieci w celu oceny ryzyka udaru.
Perspektywy leczenia i badania naukowe
W ostatnich latach perspektywy leczenia niedokrwistości sierpowatokrwinkowej (SCD) uległy znacznemu poszerzeniu, dzięki postępom w biologii molekularnej, inżynierii genetycznej oraz farmakoterapii. Choć choroba pozostaje nieuleczalna dla większości pacjentów, prowadzone są intensywne badania nad metodami umożliwiającymi trwałą korekcję defektu genetycznego i poprawę jakości życia chorych.
Terapie genowe i edycja genomu (CRISPR-Cas9)
Jedną z najbardziej obiecujących strategii leczenia przyczynowego jest terapia genowa, polegająca na:
- wprowadzeniu prawidłowej kopii genu β-globiny (HBB) do komórek macierzystych pacjenta (np. za pomocą wektorów wirusowych),
- modyfikacji ekspresji genów w celu zwiększenia produkcji hemoglobiny płodowej (HbF), która zapobiega sierpowaceniu krwinek,
- lub bezpośredniej edycji DNA metodą CRISPR-Cas9.
W 2023 roku FDA i EMA zatwierdziły pierwsze terapie genowe (np. Casgevy i Lyfgenia), które wykazały wysoką skuteczność kliniczną – w wielu przypadkach doprowadzając do całkowitego ustąpienia objawów.
Przeszczepienie allogenicznych komórek macierzystych (HSCT)
Obecnie jedyną szeroko dostępną formą leczenia przyczynowego jest przeszczepienie hematopoetycznych komórek macierzystych od zgodnego dawcy (najczęściej rodzeństwa).
- Skuteczność leczenia jest wysoka (ponad 85–90%),
- jednak procedura wiąże się z ryzykiem powikłań (odrzut przeszczepu, infekcje, GVHD)
- i ograniczoną dostępnością odpowiednich dawców.
Nowoczesna farmakoterapia
Poza klasycznym lekiem hydroksymocznikiem, który zwiększa poziom hemoglobiny płodowej i zmniejsza częstość kryzysów bólowych, wprowadzono nowe leki o ukierunkowanym działaniu:
- L-glutamina – poprawia równowagę redoks w erytrocytach i zmniejsza stres oksydacyjny.
- Voxelotor – zwiększa powinowactwo HbS do tlenu, hamując jej polimeryzację.
- Crizanlizumab – przeciwciało monoklonalne hamujące adhezję leukocytów i erytrocytów do śródbłonka, ograniczające epizody naczyniowo-okluzyjne.
Te leki oferują nowe możliwości leczenia objawowego i zapobiegania powikłaniom narządowym.
Badania kliniczne – nowe kierunki rozwoju
Obecnie trwają liczne badania kliniczne I–III fazy, które eksplorują m.in.:
- inhibitory enzymów zaangażowanych w adhezję erytrocytów,
- leki wpływające na metabolizm żelaza i stres oksydacyjny,
- terapie celowane na szpik kostny,
- immunomodulację w kontekście przeszczepień.
Równolegle prowadzone inicjatywy globalne
Organizacje takie jak WHO, NIH oraz fundacje prywatne podejmują działania na rzecz:
- zwiększenia dostępu do diagnostyki i leczenia w krajach o wysokim obciążeniu chorobą (np. Afryka Subsaharyjska),
- edukacji pacjentów i lekarzy,
- rozwoju tanich metod terapeutycznych,
- budowy rejestrów pacjentów i biobanków.
Personalizacja terapii i podejście interdyscyplinarne
Rozwój medycyny precyzyjnej otwiera możliwość indywidualnego dopasowania terapii do profilu genetycznego i klinicznego pacjenta. Kluczowe znaczenie ma tu:
- monitorowanie biomarkerów choroby,
- identyfikacja pacjentów z najwyższym ryzykiem powikłań,
- kompleksowa opieka (hematolog, neurolog, nefrolog, psycholog).
Niedokrwistość sierpowatokrwinkowa a jakość życia
Niedokrwistość sierpowatokrwinkowa znacząco wpływa na jakość życia pacjentów – zarówno fizycznie, jak i psychicznie. Częste epizody bólowe, zmęczenie, hospitalizacje i powikłania narządowe utrudniają codzienne funkcjonowanie, naukę, pracę oraz życie społeczne. Chorzy muszą na stałe dostosować tryb życia do ograniczeń wynikających z choroby, unikać stresu, infekcji, wysiłku fizycznego i odwodnienia. Dodatkowo, przewlekła choroba wiąże się z ryzykiem depresji i izolacji społecznej, szczególnie u dzieci i młodzieży. Kompleksowa opieka medyczna, wsparcie psychologiczne i edukacja pacjentów odgrywają kluczową rolę w poprawie jakości życia i funkcjonowaniu w społeczeństwie.
Niedokrwistość sierpowatokrwinkowa a suplementacja żelaza – co warto wiedzieć?
W przypadku większości anemii, żelazo odgrywa kluczową rolę – wspiera produkcję czerwonych krwinek i poprawia samopoczucie. Ale co z osobami chorującymi na niedokrwistość sierpowatokrwinkową? Czy one również powinny sięgać po suplementy żelaza?
To pytanie, które często pojawia się wśród pacjentów i opiekunów, dlatego warto rozwiać wątpliwości.
U osób z niedokrwistością sierpowatokrwinkową anemia nie wynika zazwyczaj z niedoboru żelaza, lecz z zaburzeń w budowie hemoglobiny i przewlekłego rozpadu krwinek czerwonych. Dlatego rutynowa suplementacja żelaza nie zawsze jest wskazana – ale to nie znaczy, że nie jest potrzebna nigdy.
Kiedy suplementacja żelaza może być korzystna?
W przypadku współwystępującego niedoboru żelaza (np. na skutek krwawienia z przewodu pokarmowego, obfitych miesiączek, niewłaściwej diety lub zaburzeń wchłaniania), odpowiednio dobrany preparat może realnie poprawić samopoczucie i parametry krwi.
Dlatego tak ważne są regularne badania i indywidualna konsultacja z lekarzem. Jeśli niedobór żelaza zostanie potwierdzony – warto sięgnąć po sprawdzony, dobrze tolerowany suplement, który wspiera organizm bez obciążania układu pokarmowego.
🩸 Szelazo – wspiera, kiedy trzeba.
Z myślą o osobach, które potrzebują łagodnej, skutecznej i łatwo przyswajalnej formy żelaza, powstał nasz suplement. Bezpieczny skład, wysoka jakość i przemyślana formuła – tak, aby wspomagać organizm dokładnie wtedy, gdy najbardziej tego potrzebuje.
FAQ – Niedokrwistość sierpowatokrwinkowa (SCD)
Czym dokładnie jest niedokrwistość sierpowatokrwinkowa?
To wrodzona, genetyczna choroba krwi, w której czerwone krwinki mają nieprawidłowy, sierpowaty kształt. Zamiast być elastyczne i okrągłe, stają się sztywne i łatwo się zlepiają, co utrudnia przepływ krwi i prowadzi do niedotlenienia tkanek.
Czy można się zarazić tą chorobą?
Nie. SCD to choroba dziedziczna, przekazywana w genach. Nie jest zakaźna i nie można się nią zarazić przez kontakt z drugą osobą.
Jakie są pierwsze objawy choroby?
U dzieci mogą pojawić się: przewlekłe zmęczenie, bladość, bóle kości i stawów, częste infekcje, spowolnienie wzrostu czy zażółcenie oczu. Charakterystyczne są też tzw. kryzysy bólowe, czyli nagłe i silne bóle wynikające z zablokowania przepływu krwi.
Czy można z tym normalnie żyć?
Tak, ale choroba wymaga stałej opieki lekarskiej, odpowiedniego stylu życia i unikania czynników ryzyka (np. odwodnienia, infekcji, stresu). Dzięki nowoczesnemu leczeniu wiele osób z SCD prowadzi aktywne i satysfakcjonujące życie.
Czy dzieci dziedziczą chorobę po rodzicach?
Tak – choroba rozwija się tylko wtedy, gdy dziecko otrzyma wadliwy gen od obiegu rodziców. Jeśli tylko jeden rodzic jest nosicielem, dziecko może odziedziczyć tzw. „cechę sierpowatokrwinkową” (HbAS), która zazwyczaj nie daje objawów, ale może być przekazywana dalej.
Czy chorobę da się wyleczyć?
Wyleczenie jest możliwe, ale obecnie tylko w nielicznych przypadkach – np. poprzez przeszczep szpiku kostnego od zgodnego dawcy. Obiecujące wyniki przynosi również nowoczesna terapia genowa, jednak nie jest jeszcze powszechnie dostępna.
A jeśli mam niedobór żelaza i choruję na SCD – czy mogę stosować Szelazo?
Oczywiście, jeśli niedobór żelaza został potwierdzony, Szelazo może być bezpiecznym i skutecznym wsparciem. Nasz preparat został opracowany z myślą o łagodnym działaniu i dobrej tolerancji, również u osób z przewlekłymi chorobami.
Co jeszcze warto suplementować przy niedokrwistości sierpowatokrwinkowej?
Najczęściej zalecany jest kwas foliowy, który wspiera produkcję nowych krwinek. W niektórych przypadkach lekarze mogą też zalecić witaminę B12, witaminę D czy omega-3 – wszystko zależy od indywidualnych potrzeb organizmu.